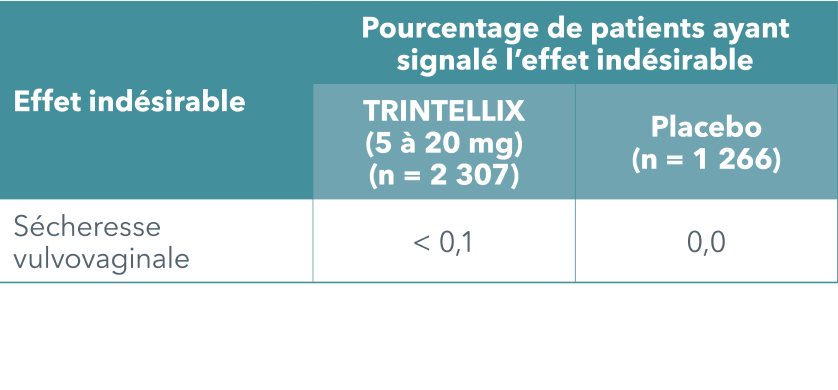
Profil de tolérabilité
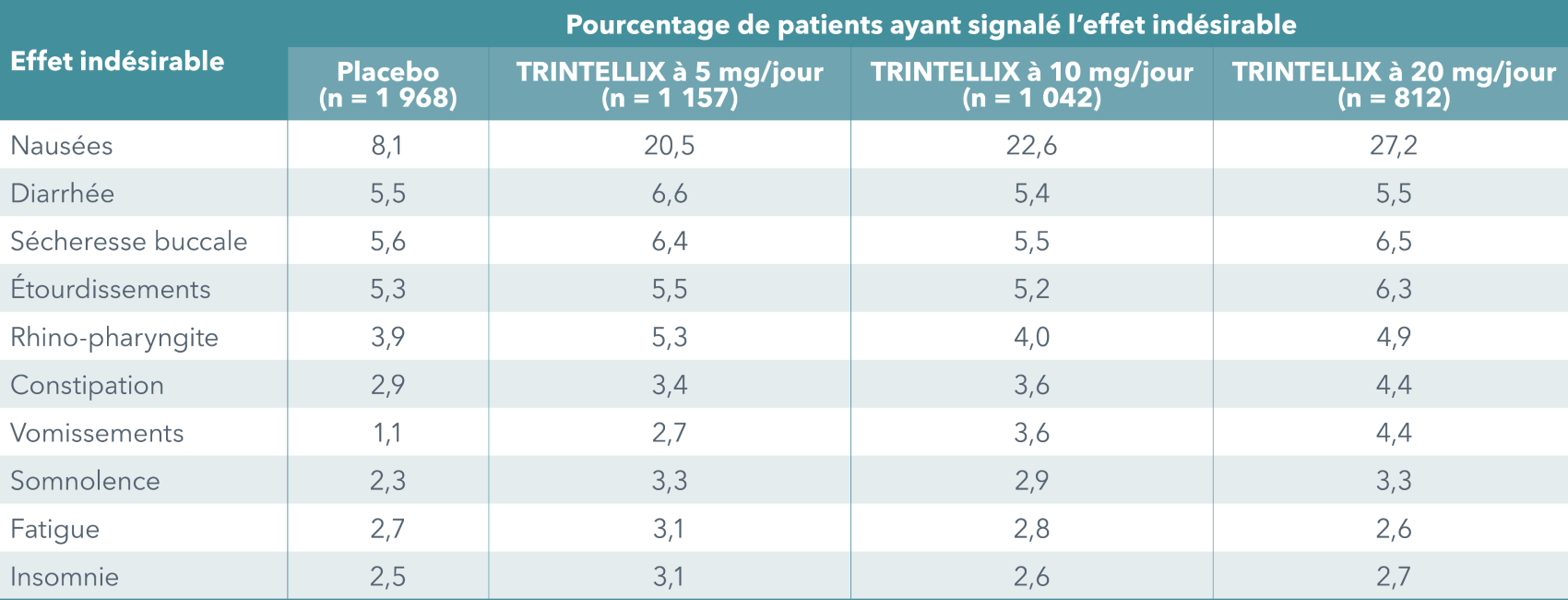
TRINTELLIX possède un excellent profil de tolérabilité1
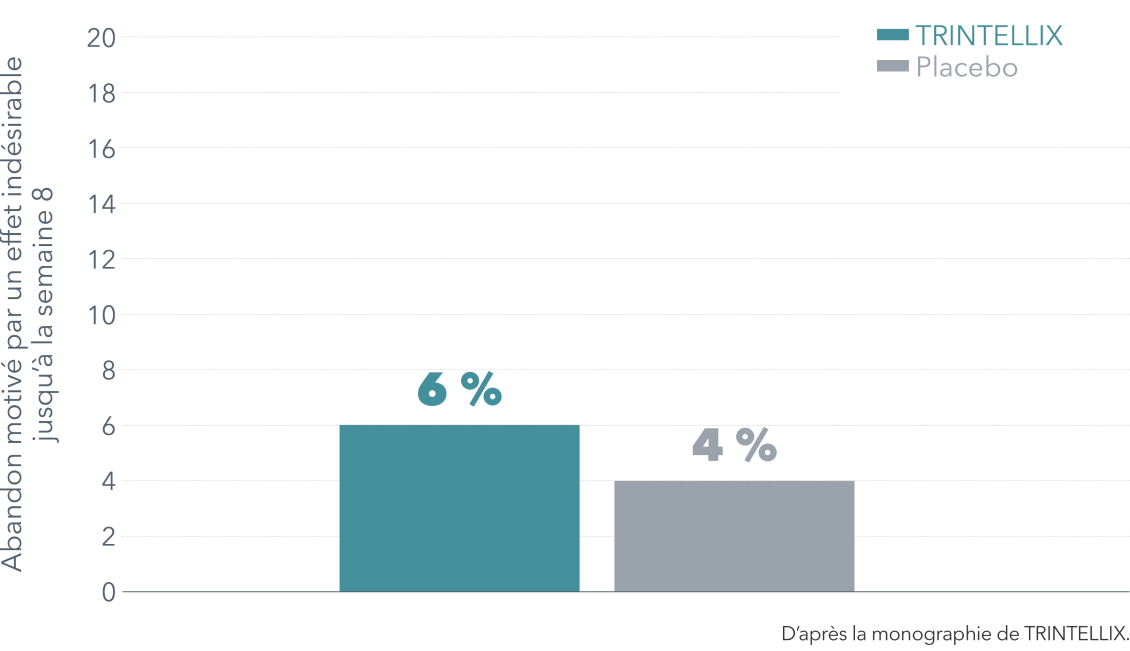
Taux d’abandon observés dans les essais de courte durée (jusqu’à 8 semaines)
Les nausées ont été le motif le plus fréquent d’abandon du traitement par TRINTELLIX lors des essais de courte durée (jusqu’à 8 semaines). L’incidence des nausées ayant conduit au retrait du médicament chez les patients qui recevaient TRINTELLIX à 5 mg, à 10 mg, à 15 mg et à 20 mg s'élevait respectivement à 1,1 %, à 1,4 %, à 3,8 % et à 3,3 %, comparativement à 0,3 % dans le groupe placebo. C’est pendant les premières semaines du traitement que les abandons pour cause de nausées ont été les plus nombreux1.
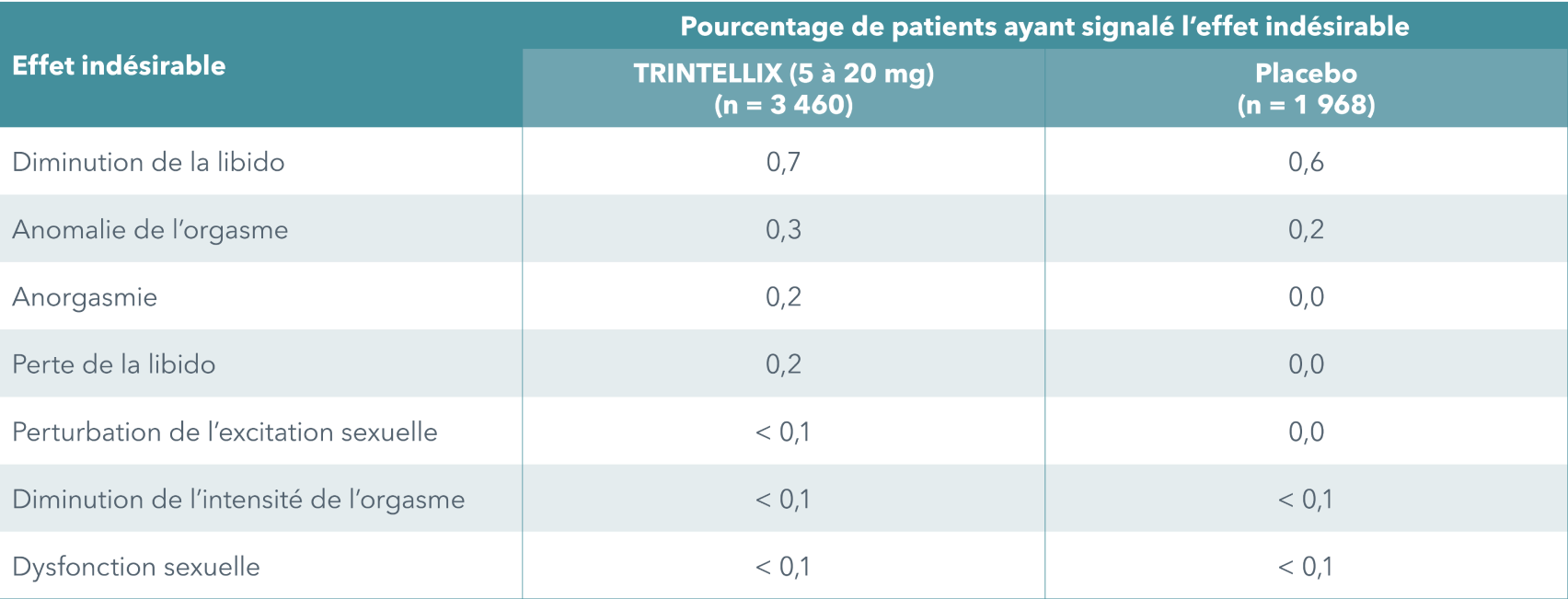
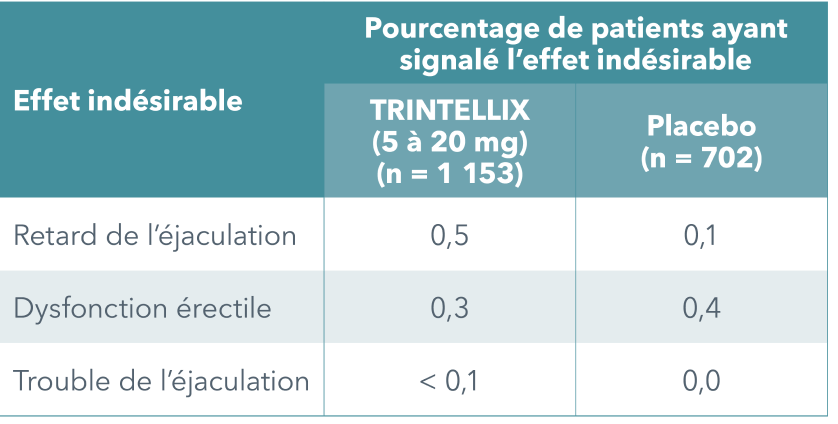
Faible incidence démontrée d'effets indésirables sur la fonction sexuelle signalés spontanément1
L’incidence des effets indésirables de nature sexuelle signalés spontanément a été faible et semblable à celle du groupe placebo lors des essais cliniques de courte et de longue durée sur TRINTELLIX (5 à 20 mg/jour).
Hommes seulement :
Femmes seulement :
- Chez les femmes : TRINTELLIX à 5 mg/jour 22 % (N= 65), 10 mg/jour 23 % (N = 94), 20 mg/jour 34 % (N = 67), placebo 20 % (N = 135).
- Chez les hommes : TRINTELLIX à 5 mg/jour 16 % (N = 67), 10 mg/jour 20 % (N = 86), 20 mg/jour 29 % (N = 59), placebo 14 % (N = 162).
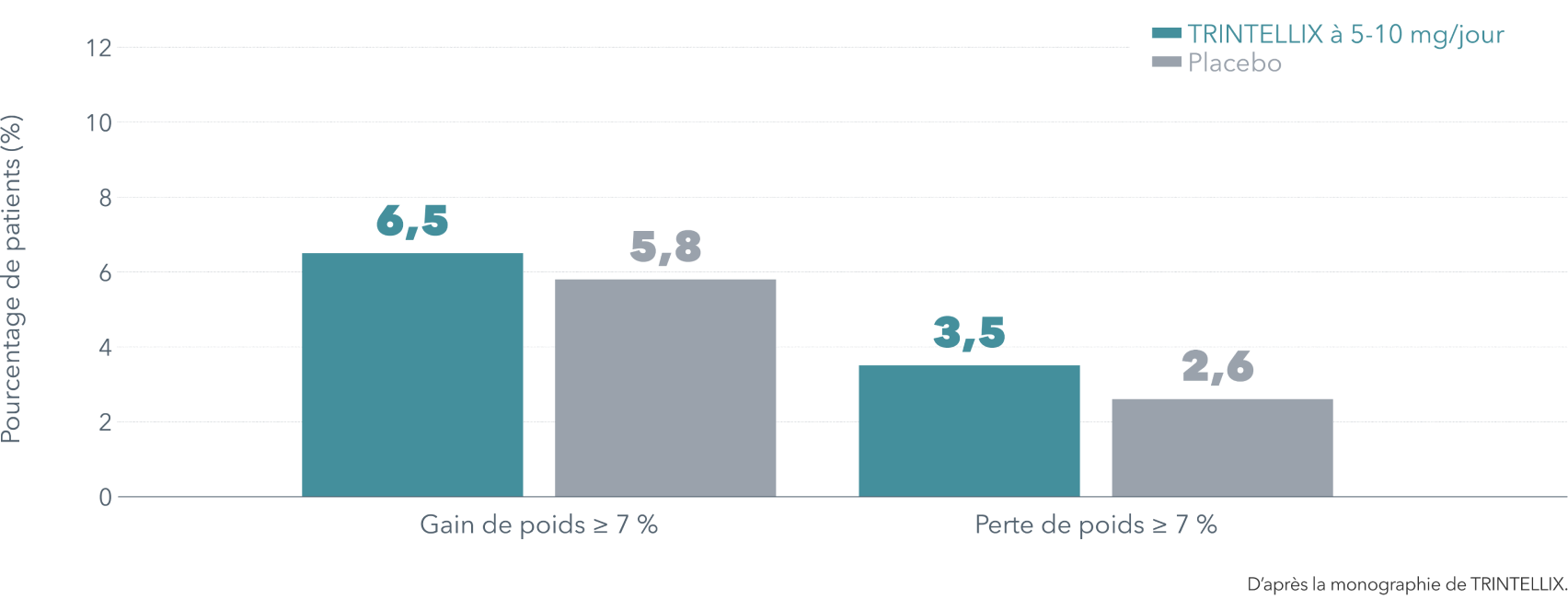
Pas d’effet cliniquement important démontré sur le poids corporel1
Variation pondérale moyenne par rapport au poids de départ dans une étude de longue durée (de 24 à 64 semaines) avec placebo : + 0,4 kg sous TRINTELLIX à 5 ou 10 mg/jour et + 0,1 kg sous placebo.
Pas d’effet cliniquement important démontré sur les paramètres de l’ÉCG1
TRINTELLIX n’a pas eu d’effet cliniquement significatif sur les paramètres de l’ECG, notamment les intervalles QT, QTc et PR et le complexe QRS, et n’a montré aucun potentiel arythmogène lors des essais cliniques.
ECG = électrocardiographie; TDM = trouble dépressif majeur
Référence : 1. Monographie de TRINTELLIX. Lundbeck Canada Inc., 27 mai 2024.