Données sur l’efficacité
TRINTELLIX a amélioré de multiples symptômes du TDM1-3†‡§
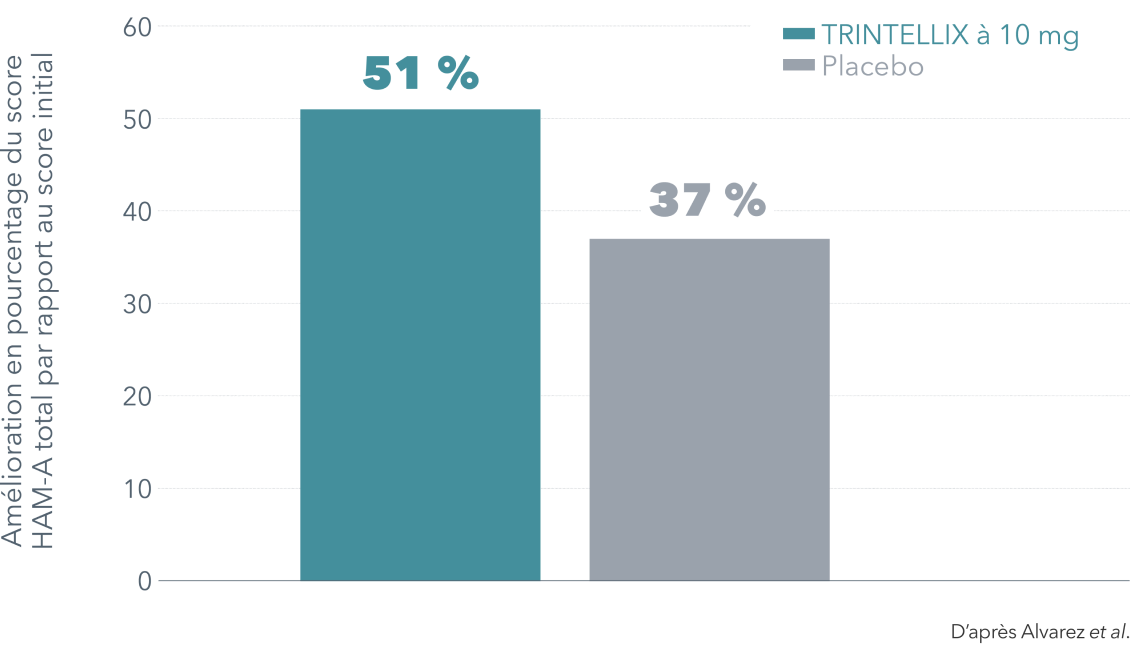
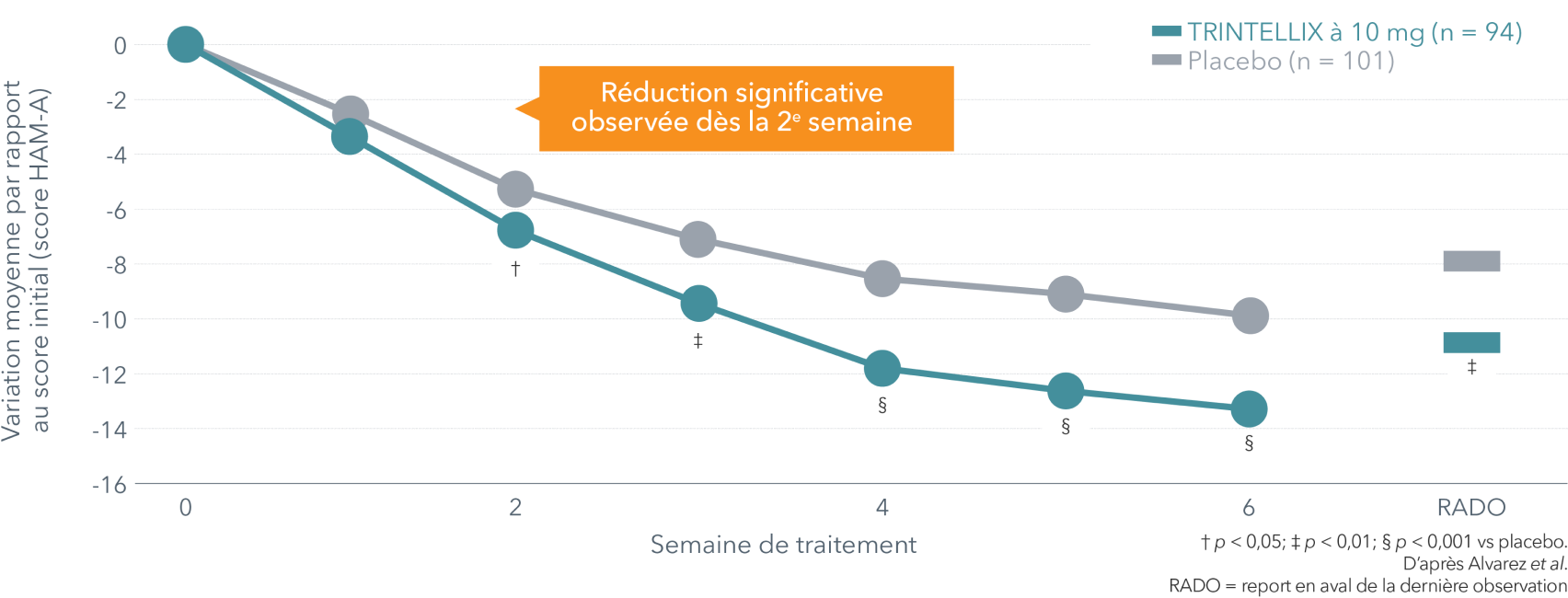
Symptômes anxieux (score HAM-A)
Environ 90 % des patients déprimés sont aux prises avec des symptômes anxieux7
Amélioration des symptômes anxieux à 6 semaines vs placebo
Amélioration des symptômes anxieux à 6 semaines vs placebo (paramètre secondaire)4¶
Dans une étude distincte, effet démontré de la vortioxétine sur le score HAM-A total semblable à celui de la venlafaxine XR chez des patients asiatiques.
Réduction moyenne (-11,4 vs -10,6) du score à 8 semaines sous TRINTELLIX à 10 mg par rapport au score initial vs venlafaxine XR à 150 mg (IC à 95 % : -2,09 à 0,45; paramètre secondaire)5II
Fonctionnement global (score SDS)
Amélioration du fonctionnement global démontrée sous TRINTELLIX à 20 mg à 8 semaines par rapport au score initial, vs sous placebo1†‡
Jusqu’à 87 % d’amélioration (-8,4 vs -4,5) du fonctionnement global (p = 0,0005)1†‡
TRINTELLIX a amélioré le fonctionnement dans la vie familiale, au travail et dans la vie sociale des patients atteints d’un TDM (paramètres secondaires)1†‡
Jusqu’à 86 % d’amélioration (-2,6 vs -1,4) du fonctionnement au travail (p = 0,0059)1†‡
Jusqu’à 82 % d’amélioration (-3,1 vs -1,7) du fonctionnement dans la vie familiale (p<0,0001)1†‡
Jusqu’à 82 % d’amélioration (-3,1 vs -1,7) du fonctionnement dans la vie sociale (p<0,0001)1†‡
† La posologie de départ et la posologie recommandée de TRINTELLIX sont de 10 mg 1 fois/jour chez les adultes de <65 ans.
Pour de plus amples renseignements sur la posologie et l’administration, consultez la monographie du produit.
CANMAT = Canadian Network for Mood and Anxiety Treatments; CGI-S = Impression clinique globale – Sévérité; DSM-IV-TR = Manuel diagnostique et statistique des troubles mentaux, 4e édition, texte révisé; DSST = test de substitution des codes; ÉDM = épisode dépressif majeur; IC = intervalle de confiance; HAM-A = échelle d’anxiété de Hamilton; MADRS = échelle de dépression de Montgomery-Åsberg; SDS = échelle d’incapacité de Sheehan; TDM = trouble dépressif majeur
‡
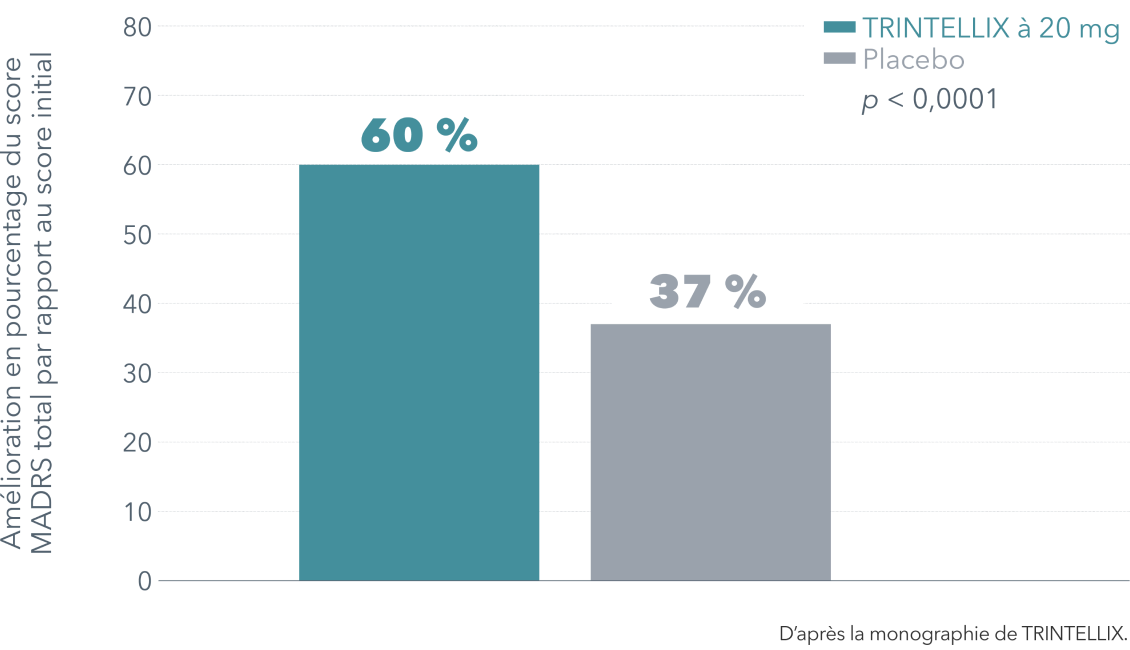
Étude menée à double insu avec placebo visant à évaluer une dose fixe chez 608 patients âgés de 18 à 75 ans dont le diagnostic principal était un TDM récurrent selon les critères du DSM-IV-TR, dont l’ÉDM en cours remontait à plus de 3 mois et dont le score MADRS total était ≥ 26. Les patients ont été randomisés de façon à recevoir TRINTELLIX à raison de 15 ou 20 mg (10 mg/jour la 1re semaine et 15 ou 20 mg/jour de la 2e à la 8e semaine) ou un placebo pendant 8 semaines. Au départ, le score MADRS total moyen s’élevait à 31,5, à 31,8 et à 31,2 dans les groupes placebo, TRINTELLIX à 15 mg et TRINTELLIX à 20 mg; le score SDS total moyen s’élevait à 19,8 sous placebo, à 20,6 sous TRINTELLIX à 15 mg et à 20,7 sous TRINTELLIX à 20 mg et le sous-score SDS Travail moyen à 6,3 sous placebo, à 6,8 sous TRINTELLIX à 15 mg et à 6,9 sous TRINTELLIX à 20 mg. Toujours au départ, le sous-score SDS Vie sociale moyen se chiffrait à 6,8 sous placebo, à 6,9 sous TRINTELLIX à 15 mg et à 6,8 sous TRINTELLIX à 20 mg et le sous-score SDS Vie familiale moyen à 6,9 sous placebo, 6,7 sous TRINTELLIX à 15 mg et à 7,0 sous TRINTELLIX à 20 mg.
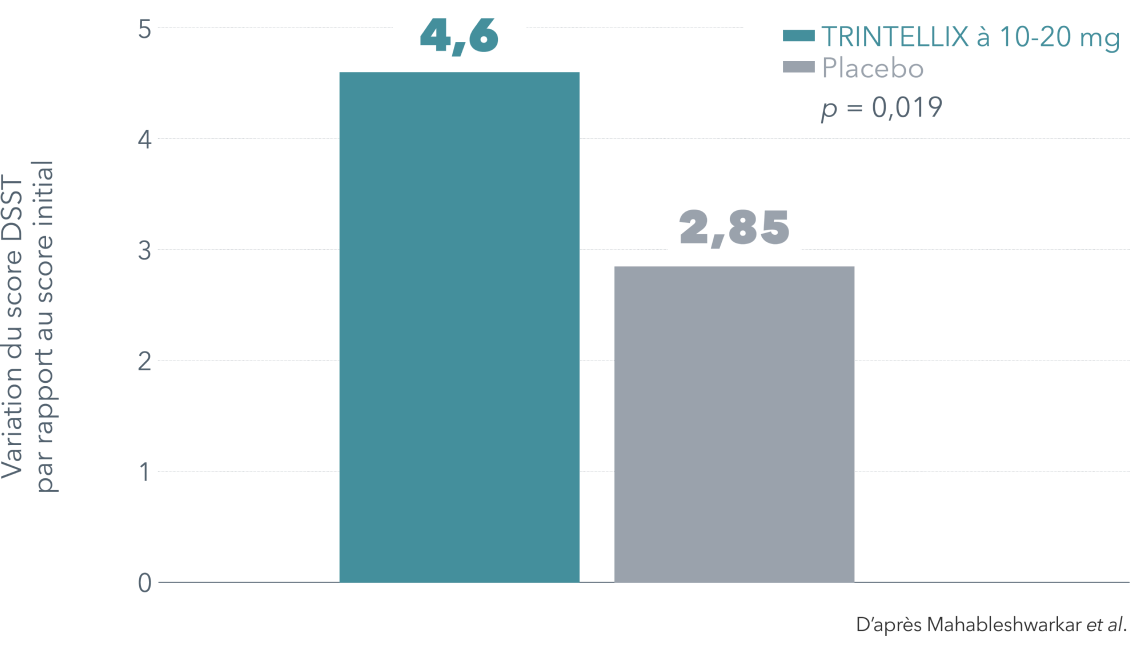
§ Étude menée à double insu avec placebo, groupes parallèles et agent actif de référence chez 602 patients âgés de 18 à 65 ans qui avaient reçu un diagnostic de TDM selon les critères du DSM-IV-TR, dont l'ÉDM en cours durait depuis ≥ 3 mois, dont le score MADRS total était ≥ 26 et qui, en outre, présentaient un dysfonctionnement cognitif subjectif comme en témoignait leur score initial < 70 au DSST. Les patients ont été randomisés de façon à recevoir 10 ou 20 mg de TRINTELLIX 1 fois/jour (n = 198) ou un placebo (n = 194) pendant 8 semaines. Le protocole prévoyait l'inclusion de la duloxétine à 60 mg 1 fois/jour (n = 207) à titre d'agent actif de référence afin de démontrer la sensibilité du test selon les critères traditionnels d'un traitement antidépresseur. Le score DSST initial moyen s'établissait à 43,5 pour le placebo, à 42,3 pour TRINTELLIX à 10 ou 20 mg et à 43,4 pour la duloxétine à 60 mg.
¶ Étude menée à double insu avec placebo et agent actif de référence visant à évaluer une dose fixe chez 429 patients âgés de 18 à 65 ans qui présentaient un ÉDM selon les critères du DSM-IV-TR et un score MADRS total ≥ 30 au départ. Les patients ont été randomisés de façon à recevoir TRINTELLIX à raison de 5 ou 10 mg pendant 6 semaines ou un placebo. Au départ, le score HAM-A moyen s'élevait à 22,9 sous placebo et à 22,3 sous TRINTELLIX à 10 mg.
|| Étude menée à double insu chez 443 patients asiatiques âgés de 18 à 65 ans atteints d'un TDM récurrent qui présentaient un ÉDM selon les critères du DSM-IV-TR, dont le score MADRS total était ≥ 26 et dont le score CGI-S était ≥ 4 au moment de la présélection et au départ. Après une période de présélection d'au plus 7 jours, les patients admis ont été randomisés de façon à recevoir une dose fixe de TRINTELLIX de 10 mg/jour ou de venlafaxine XR de 150 mg/jour (75 mg/jour les 4 premiers jours de traitement) pendant 8 semaines. L'analyse principale évaluait la non-infériorité de TRINTELLIX comparativement à la venlafaxine XR, d’après la variation du score MADRS total à 8 semaines par rapport au score initial au sein de l'ensemble d'analyse intégral. Sur l’échelle MADRS, la réponse se définissait par une diminution ≥ 50 % du score par rapport au score initial et la rémission, par un score MADRS total ≤ 10.
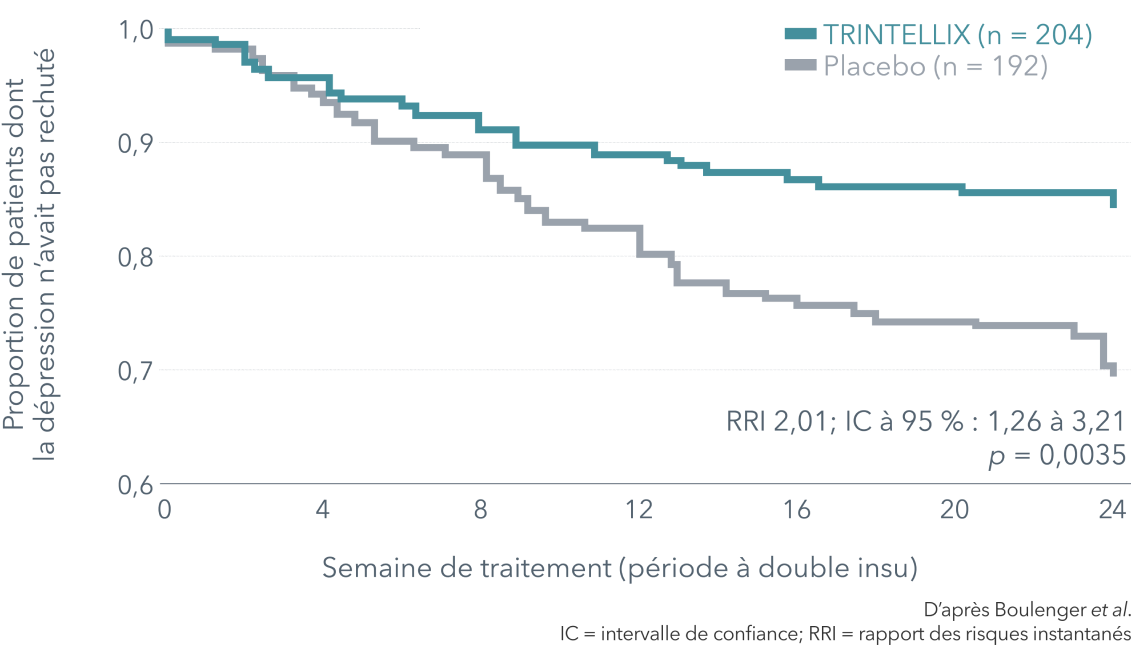
** Étude sur le maintien de l'effet menée à double insu avec randomisation et placebo chez 639 patients hospitalisés et ambulatoires âgés de 18 à 75 ans qui avaient reçu un diagnostic principal de TDM selon les critères du DSM-IV-TR, dont l'ÉDM en cours durait depuis ≥ 4 semaines, qui avaient connu ≥ 1 ÉDM antérieur et dont le score MADRS total était ≥ 26 au départ. Pendant une période initiale de 12 semaines, TRINTELLIX a été administré en une dose variable de 5 ou 10 mg/jour en mode ouvert. Les patients en rémission (score MADRS total ≤ 10) à la fois aux semaines 10 et 12 ont été randomisés de façon à recevoir, à double insu, une dose fixe de TRINTELLIX (la dose finale [5 ou 10 mg] déterminée à partir de la semaine 8 durant la période ouverte) ou un placebo. Chez environ 70 % des patients randomisés, la dose de TRINTELLIX à la fin de la période ouverte et durant la période à double insu était de 10 mg/jour. La récidive se définissait par un score MADRS total ≥ 22 ou une réponse au traitement que le chercheur jugeait insuffisante.
Références : 1. Boulenger JP et al. Efficacy and safety of vortioxetine (Lu AA21004), 15 and 20 mg/day: a randomized, double-blind, placebo-controlled, duloxetine-referenced study in the acute treatment of adult patients with major depressive disorder. Int Clin Psychopharmacol 2014;29(3):138-49. 2. Monographie de TRINTELLIX. Lundbeck Canada Inc., 27 mai 2024. 3. Mahableshwarkar AR et al. A randomized, placebo-controlled, active-reference, double-blind, flexible-dose study of the efficacy of vortioxetine on cognitive function in major depressive disorder. Neuropsychopharmacology 2015;40(8):2025-37. 4. Alvarez E et al. A double-blind, randomized, placebo-controlled, active reference study of Lu AA21004 in patients with major depressive disorder. Int J Neuropsychopharmacol 2012;15(5):589-600. 5. Wang G et al. Comparison of vortioxetine versus venlafaxine XR in adults in Asia with major depressive disorder: a randomized, double-blind study. Curr Med Res Opin 2015;31(4):785-94. 6. Boulenger JP et al. A randomized clinical study of Lu AA21004 in the prevention of relapse in patients with major depressive disorder. J Psychopharmacol 2012;26:1408-16. 7. Sadock BJ et al. Depression and bipolar disorder. Dans : Kaplan & Sadock’s Concise Textbook of Clinical Psychiatry. 3e éd. Philadelphie, PA: Lippincott Williams & Wilkins, 2008. 8. Lam RW et al. Canadian Network for Mood and Anxiety Treatments (CANMAT) 2023 Update on Clinical Guidelines for Management of Major Depressive Disorder in Adults. Can J Psychiatry 2024: 1-47.